
Walidacja w farmacji:
Walidacja jest udokumentowanym działaniem, mającym na celu udowodnienie, że zgodnie z zasadami Dobrej Praktyki Wytwarzania (GMP), wszystkie procesy i procedury, wyposażenie, materiały, czynności i system organizacyjny zapewnia wytworzenie produktu o ustalonej jakości, zgodnie z dokumentacją rejestracyjną lub wymogami farmakopealnymi, technologicznymi i koncesyjnymi.
Najnowsze rozporządzenie Ministra Zdrowia z dnia 1 października 2008 r. w sprawie wymagań Dobrej Praktyki Wytwarzania (Dz. U. Nr 184:2008 poz. 1143) ogólnie stwierdza, że walidacja to „udokumentowany program dający wysoki stopień pewności, że określony proces, metoda lub system będzie w sposób powtarzalny prowadzić do otrzymania wyników spełniających określone kryteria akceptacji”.
Częścią procesu walidacji są kwalifikacje, które są definiowane jako „działanie mające na celu wykazanie i udokumentowanie, że urządzenia lub instalacje pomocnicze są odpowiednio zainstalowane, pracują właściwie, a ich działanie rzeczywiście prowadzi do uzyskania oczekiwanych wyników”. Kwalifikacja jest częścią
walidacji, lecz poszczególne, pojedyncze etapy kwalifikacji nie stanowią procesu walidacji.
Kwalifikacja dzieli się na kilka etapów:
Kwalifikacja projektu - udokumentowana weryfikacja stwierdzająca, że proponowany projekt obiektów, systemów i urządzeń jest odpowiedni do zamierzonego celu;
Kwalifikacja instalacyjna - udokumentowana weryfikacja stwierdzająca, że obiekty, systemy i urządzenia, zainstalowane lub zmodyfikowane, są zgodne z zatwierdzonym projektem i zaleceniami producenta;
Kwalifikacja operacyjna - udokumentowana weryfikacja stwierdzająca, że obiekty, systemy i urządzenia, zainstalowane lub zainstalowane lub zmodyfikowane, funkcjonują tak, jak zamierzono w przewidywanych zakresach operacyjnych;
Kwalifikacja procesowa - udokumentowana weryfikacja stwierdzająca, że obiekty, systemy i urządzenia, jako całość, działają skutecznie i w sposób powtarzalny w odniesieniu do zatwierdzonego procesu i specyfikacji produktu;
Walidacja jest procesem skomplikowanym, co najlepiej obrazuje tzw. Model V, który przedstawia poszczególne elementy kwalifikacji powiązane z wymaganymi właściwych specyfikacji. Poszczególne poziomy specyfikacji odnoszą się do obiektu będącego w fazie koncepcji, rozwoju i wdrożenia. Każdy poziom specyfikacji ma swój odpowiednik po stronie kwalifikacji potwierdzający, że wynik spełnia zdefiniowane wymagania.
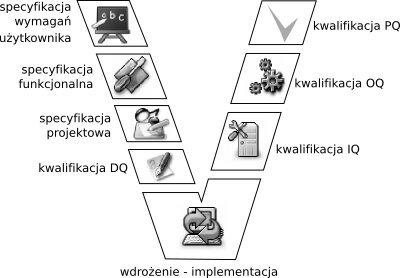
Specyfikacja Wymagań Użytkownika (User Requirement Statement / Specification) opisuje oczekiwania użytkownika wobec obiektu. URS jest kluczowym elementem wymagań tworzącym podstawę projektu lub inwestycji, co opisane jest w ISO 9001:2000 - Określenie wymagań związanych z produktem.
Specyfikacja Funkcjonalna FS (Functional Specification). Tworzona jest przez dostawcę i opisuje szczegółowe funkcje obiektu tj. to, co produkt ma wykonywać, realizować. FS jest wynikiem projektu opisującym funkcje produktu, co opisane jest w ISO 9001:2000 - Wynik projektu i wdrożenia.
Specyfikacja Projektowa DS (Design Specification), dokumentuje jak system zostanie zbudowany.
Ocena Ryzyka występuje na każdym etapie walidacji. Zespół kierujący powinien odpowiedzieć na kilka pytań:
- Czy dzięki walidacji poprawi się proces?
- Czy poprawi się jakość produktu?
- Czy będzie łatwiej odnaleźć słabe punkty?
- Czy koszty wytwarzania obniżą się?
- Czy walidacja jest niezbędna?
Walidacja w farmacji to proces bardzo obszerny. Do głównych obszarów walidacji należą:
- Walidacja produkcji form leków (sterylnych i niesterylnych)
- Walidacja produkcji substancji aktywnych luzem (API)
- Walidacja systemów komputerowych
- Walidacja metod analitycznych
- Walidacja procesów czyszczenia
- Walidacja procedur i operacji
Walidacji podlegają obiekty, systemy, instalacje i urządzenia, które po przeprowadzeniu analizy ryzyka zostaną uznane za krytyczne z punktu widzenia osiągania odpowiedniej, powtarzalnej jakości produktów. Szczególnie odpowiedzialne i skomplikowane jest przeprowadzanie walidacji i kwalifikacji instalacyjnej (IQ), operacyjnej (OQ) i procesowej (PQ) dla zakładów produkujących produkty sterylne formy leków i produktów medycznych. Krytycznymi systemami i instalacjami są wtedy najczęściej:
- Pomieszczenia czyste
- System wentylacji i klimatyzacji
- Instalacja wody oczyszczonej i pary czystej
- Instalacja sprężonego powietrza
- Instalacje gazów technicznych i laboratoryjnych
- Systemy skomputeryzowane
- System BMS i RMS






















